i.Mune® TBNK [CE]

NEU! Jetzt auch als CE-IVD Test für Trockenblutproben verfügbar!
i.Mune TBNK ist ein quantitativer in-vitro-Test zur Bestimmung der relativen und absoluten Anzahl an menschlichen Lymphozyten-Subtypen in flüssigem venösem Vollblut und zur Bestimmung der relativen Anzahl an menschlichen Lymphozyten-Subtypen in kapillarem Vollblut getrocknet auf Filterpapier (Trockenblutkarten).
i.Mune TBNK [CE] ermöglicht die Quantifizierung von:
- T-Lymphozyten (CD3+)
- B-Lymphozyten (CD19+)
- Natürliche Killer-Lymphozyten (CD16+CD56dim) (Natürliche Killer Zellen)
- Helfer-T-Lymphozyten (CD3+CD4+)
- Zytotoxische T-Lymphozyten (CD3+CD8+)
Inhalt
i.Mune TBNK [CE] besteht aus 3 Kit-Komponenten:
- i.Mune Prep (zur Vorbereitung von insgesamt 48 Proben inkl. Bisulfitkonvertierung und DNA Aufreinigung)
- i.Mune TBNK Amp (zur Amplifikation von insgesamt 48 Proben mittels real-time PCR)
- i.Mune Check (Kontroll-Reagenzien für insgesamt 12 real-time PCR Läufe)
- Zusätzlich stellen wir ein Datenanalyse-Tool (MS-Excel) zur Verfügung.
Probenanforderungen
- Trockenblut (Kapillarblut auf Filterpapier getrocknet)
-
- Proben können bei Raumtemperatur (15°C bis 30°C) oder gefroren (-30°C bis -15°C) bis zu 12 Wochen gelagert werden
ODER
- 40 µl flüssiges venöses Vollblut, das in einem K2EDTA Blutentnahmeröhrchen gesammelt wurde.
-
- Die Blutproben können bei Raumtemperatur (15°C bis 30°C) für bis zu 24 h gelagert werden
Anwendungen
Laut Publikationen kann die Quantifizierung von T-/B- und NK-Lymphozyten hilfreich sein für*:
- Follow-up und diagnostische Bewertung einer primären Immundefizienz1),2)
- Überwachung von HIV-positiven Patienten1),3)
- Immunüberwachung nach immunsuppressiver Therapie bei Transplantation, Autoimmunität und anderen immunologischen Erkrankungen4)
- Verfolgung der Immunrekonstitution nach hämatopoetischer Stammzelltransplantation5)
- Absolute Quantifizierung zirkulierender B-Zellen bei PatientInnen, die mit B-Zell-depletierenden Therapien behandelt werden6)
Bitte kontaktieren Sie uns für ein Angebot:
*Die genannten klinischen Anwendungen wurden mit Technologien entwickelt, die derzeit in der klinischen Labor Routine eingesetzt werden (z.B. Durchflusszytometrie).
Leistungscharakteristika
Die Leistungscharakteristika des i.Mune TBNK [CE] wurden nach den Vorgaben der CLSI Standards durchgeführt.
| Wiederholbarkeit (ein Standort) | CV < 12,5% (flüssiges venöses Vollblut); CV < 25% (Trockenblut) |
| Präzision (ein Standort) |
CV < 25% (flüssiges venöses Vollblut; Trockenblut) |
| Reproduzierbarkeit (mehrere Standorte) |
CV < 25% (flüssiges venöses Vollblut) |
| Präzision (mehrere Standorte) |
CV < 25% (flüssiges venöses Vollblut) |
| Linearität |
10 - 40 µl (flüssiges venöses Vollblut) |
| Nachweisgrenze |
< 100 Kopien (flüssiges venöses Vollblut; Trockenblut) |
| Zuverlässigkeit |
99% (flüssiges venöses Vollblut; Trockenblut) |
| Interferenz |
Keine Interferenz bei Bilirubin (0,4 mg/ml), |
Klinische Leistungsdaten:
Die klinische Leistungsbewertung wurde mit 113 flüssigen venösen Vollblutproben von selbsterklärten gesunden Spendern durchgeführt. Die Proben wurden prospektiv in K2EDTA-Blutentnahme-röhrchen gesammelt und sowohl mit dem i.Mune TBNK [CE] Test als auch mit der Durchflusszytometrie gemessen. Die Ergebnisse beider Methoden wurden unter Verwendung des Spearman-Korrelationskoeffizienten (Spearman r) für jeden Assay (% und Zellen/μl) verglichen.
| Test | Spearman r | p Wert |
| CD3 Zellen/µl | 0,82 | <0,0001 |
| CD4 Zellen/µl | 0,70 | <0,0001 |
| CD8 Zellen/µl | 0,55 | <0,0001 |
| BLC Zellen/µl | 0,79 | <0,0001 |
| NKC Zellen | 0,70 | <0,0001 |
| Leukozyten/µl | 0,70 | <0,0001 |
| CD3 % der Leukozyten | 0,85 | <0,0001 |
| CD4 % der Leukozyten | 0,76 | <0,0001 |
| CD8 % der Leukozyten | 0,53 | <0,0001 |
| BLC % der Leukozyten | 0,86 | <0,0001 |
| NKC % der Leukozyten | 0,78 | <0,0001 |
Relative Quantifizierung (% Leukozyten)

r = 0,90
Absolute Quantifizierung (Zellen/µl)
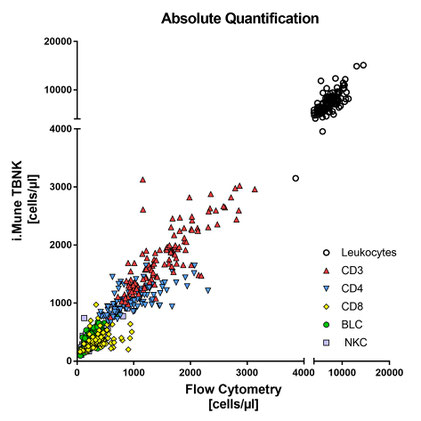
r = 0,96
Referenzwerte
112 flüssige venöse Blutproben und 108 kapillare Vollblutproben wurden prospektiv von selbstdeklarierten gesunden Probanden (Alter 18 bis 71 Jahre; weiblich und männlich) entnommen und mit i.Mune™ TBNK [CE] analysiert. Die Referenzbereiche für die einzelnen Lymphozyten-Untergruppen wurden unter Verwendung der Unter- und Obergrenze für jeden Zelltyp unter Anwendung eines Perzentils von 2,5 bis 97,5 definiert. Die Abbildung zeigt den Vergleich zwischen flüssigem venösen Vollblut und DBS-Proben.

Literatur
- Baron U. et al. Epigenetic immune cell counting in human blood samples for immunodiagnostics. Sci Transl Med. 2018 Aug 1; 10 (452)
- Aluri J, et al. Clinical, Immunological, and Molecular Findings in 57 Patients With Severe Combined Immunodeficiency (SCID) From India. Front Immunol. 2019 Feb 4;10:23
- Ford N, et al. The evolving role of CD4 cell counts in HIV care. Curr Opin HIV AIDS. 2017 Mar;12(2):123-128
- Omana-Zapata I, et al. Accurate and reproducible enumeration of T-, B-, and NK lymphocytes using the BD FACSLyric 10-color system: A multisite clinical evaluation. PLoS One. 2019 Jan 28;14(1):e0211207
- Riley RS. Laboratory evaluation of the cellular immune system. In: McPherson RA, Pincus MR, eds. Henry's Clinical Diagnosis and Management by Laboratory Methods. 23rd ed. St Louis, MO: Elsevier; 2017:chap 45
- Hallek M, et al. International Workshop on Chronic Lymphocytic Leukemia. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood. 2008 Jun 15;111(12):5446-56